La sofisticada arma de las bacterias para figurar entre los seres vivos más rápidos del mundo
Un grupo de científicos desvela cómo los microorganismos más abundantes construyen su sistema de propulsión, que puede imitarse y utilizarse para atacarlos o favorecerlos
/cloudfront-eu-central-1.images.arcpublishing.com/prisa/STRELDLVOJCIXES3DGXSNNXGUI.jpg)
Las bacterias, los organismos más abundantes del planeta y responsables desde de generar la placa dental hasta de mantener la fertilidad de la tierra, tienen apariencia simple y un tamaño insignificante a escala humana (entre 0,5 y 5 micrómetros de longitud). Sin embargo, estos microorganismos, capaces de desarrollar resistencia a los antibióticos y suponer una amenaza para millones de personas, son, según la microbióloga Marta Pulido-Sánchez, de la Universidad Pablo de Olvide (UPO) y del Centro Andaluz de Biología del Desarrollo (CABD), “una auténtica máquina molecular”. Comprenderla abre la puerta a desarrollos tecnológicos y a tratamientos para favorecerla, cuando es beneficiosa, o limitarla, cuando no. Un equipo de la UPO y el CABD ha desvelado uno de los mecanismos fundamentales de las bacterias para colonizar espacios: los flagelos, una estructura que las convierte en uno de los seres vivos más rápidos del mundo, ya que pueden recorrer en un solo segundo el espacio equivalente a 100 veces su longitud. Como si una persona de 1,70 metros se moviera a unos 600 kilómetros por hora.
En el cuerpo de las personas hay aproximadamente 10 veces más células bacterianas que humanas. En muchos casos son inofensivas o incluso beneficiosas, como las que forman parte del microbioma del tracto digestivo. Sin embargo, las patógenas suponen una amenaza cada vez mayor. Su capacidad de supervivencia depende en gran parte de su aptitud para desplazarse, función que utilizan para colonizar espacios o huir de amenazas. En este sentido, Pulido-Sánchez explica: “Estudiar cómo se comportan y funcionan las bacterias es determinante para conocer los numerosos procesos fundamentales para la vida en los que participan”.
El Centro Andaluz de Biología del Desarrollo, centro mixto de la UPO, el Consejo Superior de Investigaciones Científicas (CSIC) y la Junta de Andalucía, lleva más de una década estudiando cómo las bacterias forman comunidades que generan, por ejemplo, la placa dental o una infección grave. Una de las claves es su movilidad, una función vital para colonizar, defenderse o atacar. Y el arma clave de esta es el flagelo, un complejo molecular alargado formado por hasta 30 proteínas diferentes, según la especie, capaz de propulsar a la bacteria a velocidades únicas y dirigirla a nuevos espacios.
Este reino de la velocidad proporcional al cuerpo está dominado por los organismos microscópicos. El récord, según la Universidad de Ratisbona (Alemania), es para la arquea, un organismo unicelular capaz de recorrer en un segundo una distancia equivalente a 500 veces su tamaño.
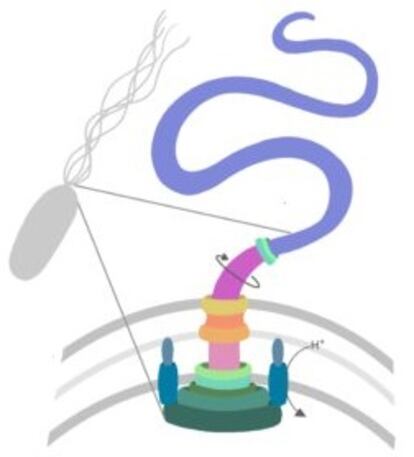
El flagelo bacteriano se parece a las hélices. El motor biológico está anclado a la pared celular y convierte una corriente eléctrica (de protones) en movimiento de rotación. Un sistema, a modo de interruptor, permite cambiar el sentido del giro al actuar sobre un eje que conecta la fuente de energía con el filamento, el apéndice proteico que sobresale de la célula y que funciona como las palas de la hélice. Entender esta estructura singular es fundamental, ya que eliminar o alterar cualquiera de las partes que conforman esta “máquina molecular” permitiría interrumpir las funciones del sistema o aprovecharla, según relata la microbióloga española, para dirigir, por ejemplo, un fármaco a un determinado lugar del organismo.
En este sentido, Martin Schmeing, profesor de bioquímica en la Universidad de McGill (Canadá) y autor de un reciente estudio sobre bacterias publicado en Nature Chemical Biology, destaca la importancia del motor energético bacteriano: “Las bacterias pueden almacenar recursos adicionales para los tiempos de vacas flacas. Es un poco como mantener una alcancía o llevar una batería de respaldo”. La enzima que produce estas baterías se ha investigado para el tratamiento de aguas y para la creación de nanovesículas sensibles al calor para su uso en la administración dirigida de fármacos.
Por su parte, Blas Vinagre, catedrático de Ingeniería eléctrica, electrónica y automática de la Universidad de Extremadura, ha expuesto en la Uned las oportunidades de crear robots nadadores tipo flagelo bacteriano por sus aplicaciones en diferentes campos, desde la medicina (procedimientos diagnósticos y terapéuticos menos invasivos) hasta la industria (tareas de inspección en infraestructuras y máquinas).
El trabajo que ha desvelado la maquinaria del flagelo bacteriano, dirigido por Fernando Govantes, científico del Área de Microbiología de la Universidad Pablo de Olavide, ha sido publicado en la revista Environmental Microbiology. El investigador explica que han utilizado como organismo modelo la Pseudomonas putida, “una bacteria”, según afirma, “de gran interés en biotecnología ambiental y agricultura, ya que se asocia a las raíces de las plantas y promueve su crecimiento, a la vez que las protege de posibles patógenos”.
En esta bacteria, las instrucciones para fabricar las piezas del flagelo se encuentran agrupadas juntas en el genoma, como si fueran un manual, según detalla la UPO y el CSIC. El modelo que la comunidad científica asumía hasta ahora se basaba en que los genes flagelares se expresan por grupos muy definidos en tres o cuatro oleadas de manera secuencial denominados saltos de la cascada. Primero se expresan las proteínas que dan la orden a la célula para empezar a construir el flagelo. Estas proteínas se encargan de hacer que se exprese el núcleo central de la máquina que se inserta dentro de la pared celular. Más tarde, otras dan la orden para construir el filamento que se extiende hacia afuera de la bacteria.
Govantes detalla: “Sin embargo, con la estrategia que hemos seguido integrando resultados de análisis diferentes, hemos descubierto en la Pseudomonas putida que la realidad es mucho más compleja: no solo existen estos saltos en la cascada, sino que nos encontramos con un segundo nivel de regulación superpuesto: proteínas que ordenan la construcción de las últimas piezas de la máquina también ordenan que se fabriquen más piezas de las iniciales. Además, cuando se escriben las instrucciones para hacer el filamento, se escriben a la vez las que hacen que la célula vuelva a iniciar la síntesis del flagelo desde el principio”.
Pulido-Sanchez precisa: “Las instrucciones se solapan unas con otras; es decir, que cuando se escriben las instrucciones para fabricar los últimos componentes, las últimas piezas del flagelo, se escriben a la vez las instrucciones para fabricar la proteína responsable de iniciar la síntesis”. El sentido de este último mecanismo, desconocido hasta ahora, será uno de los campos de investigación del grupo.
Puedes seguir a MATERIA en Facebook, Twitter e Instagram, o apuntarte aquí para recibir nuestra newsletter semanal.
Sobre la firma